Immunsystemet bekjemper sopp, parasitter, bakterier, virus og toksiner,
samt fjerner skadde, destruktive, døende og døde kroppsceller.
Immunsystemet er et cellulært og molekylært uhyre komplisert system der et stort antall aktører agerer og kommuniserer med hverandre. Studiet av immunologi byr på flere store pedagogiske utfordringer. Ett pedagogisk problem er at immunsystemet fremstår som et evolusjonært «lappeteppe» der funksjonene til de mange aktørene i stor grad overlapper hverandre. Det er derfor vanskelig å få øye på den overordnede «mesterplanen» bak immunsystemet; mange immunologer vil kanskje hevde at det ikke er noen. Et annet pedagogisk problem er at til tross for immunsystemets lappeteppe-preg er det en meget høy og avansert grad av kommunikasjon og integrasjon mellom dets aktører. Dette gjør det vanskelig å studere og formidle faget «komponentvis», fordi hver aktør må forstås i kontekst av og i relasjon til de øvrige aktørene. Et tredje pedagogisk problem er den særdeles kronglete terminologien, som har et lappeteppe-preg bestående av termer som går tilbake til 1890-tallet. Disse pedagogiske problemene gjør at presentasjoner av immunsystemet sjeldent blir god eller elegant litteratur.
Huden er vår fremste og største forsvarslinje mot infeksjoner, og man kan si at huden har sitt eget immunsystem, analogt til immunsystemer i andre organer som tarm og bronkier [Bjerke (2002): Huden som immunologisk organ].
Immunologien deler immunsystemet opp i to hoveddeler, det generelle og det adaptive immunforsvaret. De er dypt integrert i hverandre. Det generelle immunforsvaret blir vanligvis kalt for «det medfødte», «det uspesifikke» eller «det ikke-adaptive» immunforsvaret (Wiki: Innate immune system). Når et fremmedlegeme først har klart å komme forbi huden, er det det generelle immunforsvaret som står for immunsystemets «primærrespons», og som i de fleste tilfeller klarer å rydde opp på egen hånd. Under primærresponsen blir mikroben ideelt sett nøytralisert og spist opp av enkelte celletyper tilhørende det generelle immunforsvaret. Disse immuncellene bringer så et peptid (fragment av et protein eller polysakkarid) som tilhørte den fordøyde mikrobens overflate til sin egen celleoverflate. Peptidet blir på celleoverflaten presentert for de øvrige aktørene i immunforsvaret, omtrent som sheriffene i «the Wild West» hang opp plakater med overskriften «WANTED: Dead or Alive» med et bilde av forbryteren under.

Poster fra The Wild West,
analog til et presentert peptid.
Mens alle fremmedlegemer som fremprovoserer en initiell respons fra immunsystemet bør generelt kalles for et immunogen, blir det presenterte peptidet kalt for et et antigen, som står for «antibody generator»). Termen antigen ble opprinnelig lansert i 1899 av den ungarske lege og mikrobiolog Laszlo Detre (1874–1939). Frem til 1959 ble termene immunogen og antigen brukt om hverandre, men så ble det et tiltagende behov for å gi hver av dem sin presise betydning.
De presenterte peptidene tiltrekker seg forskjellige typer dreperceller, inkludert aktører fra det adaptive immunforsvaret (Wiki: Adaptive immune system). Disse aktørene produserer bl.a. molekylære Y-formete antistoffer som sirkulerer i blodet og i lymfene på jakt etter mikrober med det spesifikke peptidet på sin overflate. Dersom antistoffet finner mikroben den søker etter, kan den noen ganger nøytralisere mikroben på egen hånd, og andre ganger bare binde seg til mikroben og signalisere til immunceller om hjelp til å drepe den.
Aktørene fra det adaptive immunforsvaret produserer også hukommelsesceller som «husker» det spesifikke peptidet. Hvis den samme mikroben skulle dukke opp på ny, opp til 3-5 år senere, vil hukommelsescellene bidra til en immunrespons som er raskere og mer effektiv enn ved første møte.
Før vi tar for oss hver av immunsystemets hovedaktører, kan innledningen over presenteres ett hakk mer detaljert, i fire punkter:
1) En inntrenger, f.eks. bakterie eller virus, blir oppdaget, drept og fordøyd av dreperceller (fagocytter) tilhørende det generelle immunforsvaret.
2) Et peptid (fragment av et protein eller polysakkarid) fra den fordøyde inntrengeren blir inne i drepercellen «lastet på» en molekylgruppe kalt HLA-molekyler (MHC-klasse II), som så migrerer til cellens overflate. På cellens ytre overflate blir peptidet, bundet til HLA-molekylene, presentert for omverdenen som et antigen. Drepercellen har med dette gått inn i rollen som en antigen-presenterende celle (APC), en rolle som også andre immuncelletyper kan gå inn i.
3) Drepercellens presentasjon av antigenet tiltrekker seg sirkulerende T-celler, som tilhører det adaptive immunforsvaret. Dersom T-cellens overflatereseptor (TCR) matcher det presenterte antigenet, vil TCR binde seg til antigenet. TCR vil da signalisere til T-cellen at den skal differensiere seg til enten T-drepercelle eller T-hjelpercelle.
4) T-hjelpercellene kan aktivere «naive» (antigen-uerfarne) B-celler, som også tilhører det adaptive immunforsvaret. Aktiverte B-celler differensieres hovedsakelig til B-plasmaceller, som produserer og utskiller frie antistoffer som er designet til å nøytralisere akkurat det antigenet som T-hjelpercellen ble presentert for. Disse antistoffene sirkulerer i blodet og i vevsvæskene på jakt etter mikrober som har det spesifikke antigenet på sin overflate. Et lite mindretall av aktiverte B-celler differensierer seg til B-hukommelsesceller som kan «huske» det spesifikke antigenet i mange år fremover. Det er disse hukommelsescellene som sørger for at neste gang en inntrenger med det spesifikke antigenet dukker opp, er immunsystemet klar til en raskere og mer effektiv respons enn første gang.
Det er en høy grad av kommunikasjon, interaktivitet og samarbeid mellom alle aktørene i immunsystemet. Dette skjer i stor grad via kjemiske signaler kallt cytokiner.
a) Det generelle immunforsvaret
Fagocytt (Wiki: Phagocyte). Fagocytt (fra gresk phagein: å spise) er et fellenavn på en gruppe immunceller – som inkluderer makrofager, dendrittceller og mastceller – som jafser i seg uønskede patogener samt døde og døende kroppsceller. De kan enkelt forestilles som Pac-Man (den gule sirkelen med munn som beveger rundt i en labyrint) som ble lansert i 1980 i elektromekaniske spill for barn. Én liter blod inneholder omtrent 6 milliarder fagocytter. En fagocytt bruker gjennomsnittlig 9 minutter på å spise en bakterie. Når fagocytten har spist opp patogenet, går den inn i rollen som antigen-presenterende celle (APC) ved å bringe et peptid fra patogenet opp til sin egen overflate, der peptidet presenteres for immunceller fra det adaptive immunforsvaret.
Den russiske zoologen Ilya Ilyich Mechnikov (1845–1916) oppdaget fagocyttene i 1882. Hans studier av disse resulterte i at han i 1908 fikk Nobelprisen i medisin/fysiologi. Det var imidlertid først på 1980-tallet at de intrikate relasjonene mellom fagocyttene og alle de øvrige aktørene i immunsystemet ble kjent.
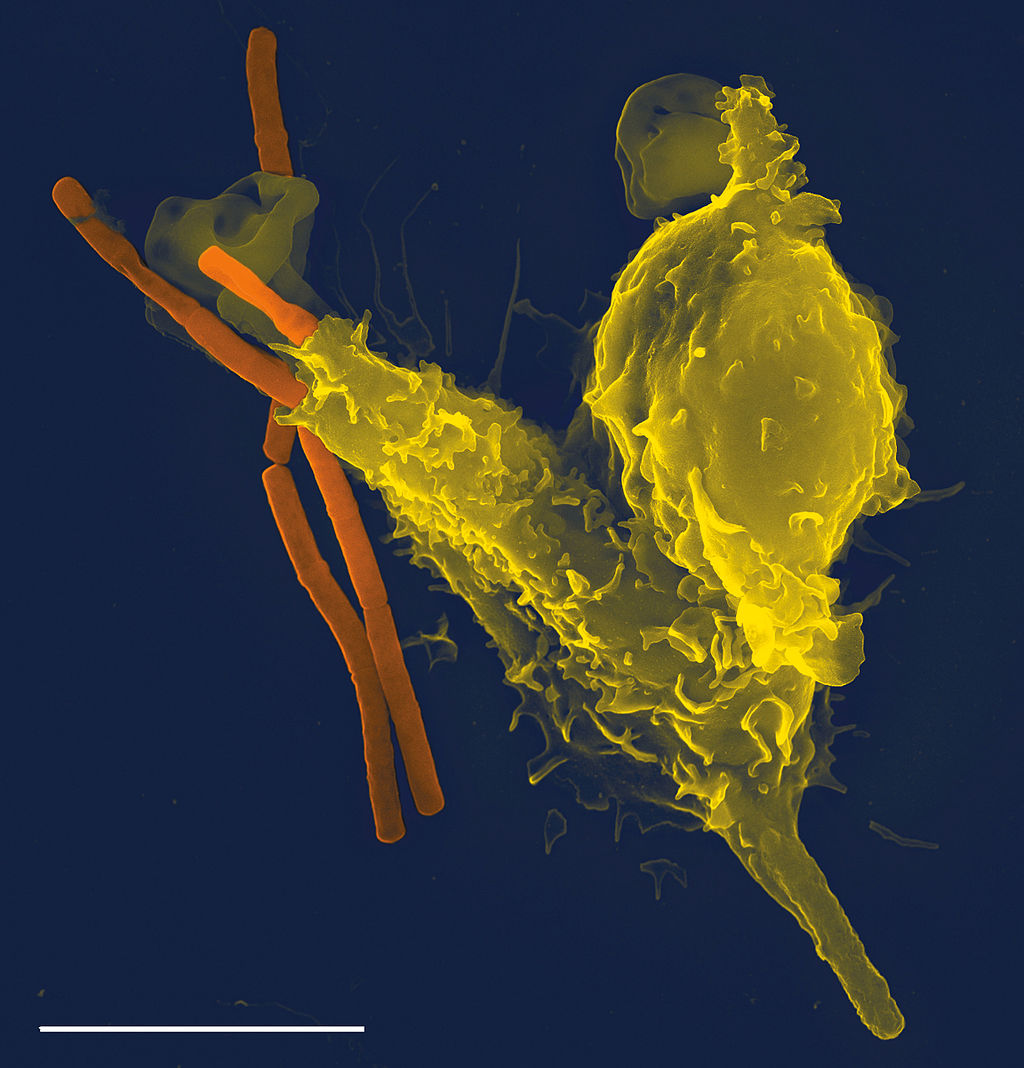
Fagocytt (gul) som spiser en miltbrannbakterie (orange).
Naturlig drepercelle (Wiki: Natural killer cell). Naturlig drepercelle, som forkortes til NK-celle, er i motsetning til fagocyttene ikke på utkikk etter invaderende patogener, men etter stressede kroppsceller som bør fjernes. Dette gjelder først og fremst virusinfiserte celler og svulstceller. NK-celler er unike ved at de kan gjenkjenne stressede kroppsceller selv om de ikke presenterer et antigen på overflaten. NK-cellen komplementerer på denne måten funksjonene til de andre immuncelletypene.
NK-cellen ble først oppdaget i mus, og ble første gang beskrevet i 1975 i to artikler av den svenske Rolf Kiessling-gruppen. I 2009 oppdaget forskere at NK-cellen har immunologisk hukommelse, hvilket er ganske oppsiktsvekkende. Det betyr at NK-cellen like mye utgjør en integrert del av det adaptive immunforsvaret som av det generelle immunforsvaret (se Pyzik og Vidal, 2009).
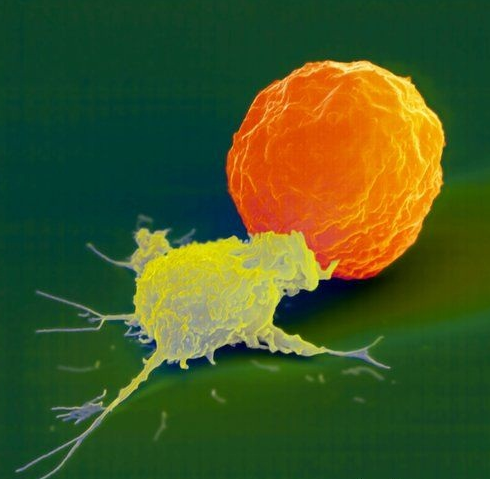
NK-celle (gul) angriper kreftcelle (orange).
Komplementsystemet (Wiki: Komplementsystem; Complement system). Komplementsystemet består av over 30 små proteiner og proteinfragmenter i blodet som hjelper til («komplementerer») fagocyttene og antistoffene med å bli kvitt patogener i kroppen. Disse proteinene har kodenavn fra C1 til C9. Termen “komplement” ble introdusert av den tysk-jødiske legen og forskeren Paul Ehrlich (1854-19115) på slutten av 1890-tallet, som en del av hans større teori om immunsystemet.
B1-celle og «naturlig antistoff» (Wiki: B-1 cell). B1-cellene produseres i forsterperioden, mens de konvensjonelle B-cellene (som tilhører det adaptive immunforsvaret) produseres først etter fødselen. B1-cellene og de «naturlige antistoffer», hovedsakelig IgM, har en viktig funksjon i å bekjempe patogener og svulstceller. Antistoffene kalles naturlige fordi de produseres uten tidligere infeksjon, vaksinasjon, eller eksponering for fremmede antigener.
MHC-komplekset/HLA-molekyler: individ-unike celleoverflateproteiner som presenterer internaliserte antigener
· Wiki (eng.): Major histocompatibility complex; Human leukocyte antigen.
· Wiki (no.): Vevstypeantigen.
MHC-komplekset, også kalt vevstypeantigen, er et sett molekyler på overflaten til de aller fleste celler i alle virveldyr. Den menneskelige varianten herav kalles for humant levkocyttantigen, som kan forenkles til HLA-molekyler. De første beskrivelsene av MHC-komplekset ble gitt i 1936 av den britiske immunologen Peter Alfred Gorer (1907-1961).
HLA-molekylene har flere funksjoner, bl.a. å bringe et peptid fra en fordøyd inntrenger til celleoverflaten for der å presentere peptidet som et antigen.
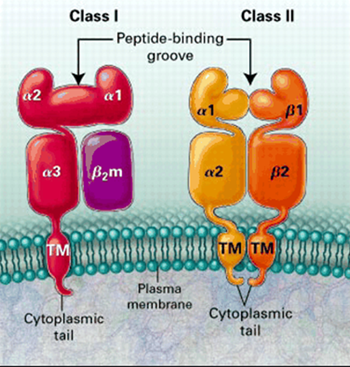
HLA-molekyler på celleoverflaten.
MHC-familien består av tre undergrupper: klasse I, klasse II og klasse III. Klassene I og II er relatert til presentasjon av antigener.
MHC-klasse1-molekyler presenterer som antigen peptider fra proteiner (inkludert virale proteiner) som kommer fra cellesaften, altså endogene eller intracellulære antigener. Celler som presenterer antigen med MHC-klasse1-molekyler tiltrekker seg T-dreperceller, som dreper cellen.
MHC-klasse2-molekyler presenterer som antigen peptider fra proteiner som kommer utenfra cellen, altså eksogene eller extracellulære antigener. Dette vil i hovedsak være proteiner som kommer fra bakterier, parasitter og toksiner. Normalt er det bare i antigen-presenterende immunceller (APC) at MHC-klasse2-molekyler presenterer antigen. APC som presenterer antigen med MHC-klasse2-molekyler tiltrekker seg T-hjelperceller og T-dreperceller, som igjen aktiverer B-celler, som så produserer antigen-spesifikke antistoffer og hukommelsesceller.
HLA-molekylene er unike for hvert enkelt individ, hvilket betyr at immuncellene kan skille mellom kroppsegne og kroppsfremmede celler. Dette er årsaken til at transplanterte organer blir avvist av kroppens immunsystem, dersom immunsystemet ikke blir dempet med medikamenter.
b) Det adaptive immunforsvaret
Det adaptive immunforsvaret utvikles hovedsakelig i løpet av menneskets første leveår. Det består primært av T-lymfocyttene (T-celler) som kommer fra thymus (brisselen) i halsregionen, og B-lymfocyttene (B-celler) som kommer fra beinmargen.
T-CELLER (Wiki: T cell)
T-celler er immunceller som bare kan binde seg til celler som presenterer et matchende antigen. T-celler har fått sitt navn etter thymus. Det som særpreger T-cellene, er at de på overflaten har molekylære T-cellereseptorer (TCR). Disse er spesifikke men tilfeldige, hvilket betyr at det må produseres et meget stort antall T-celler med forskjellig utformete TCR’er for å kunne matche et spesifikt antigen som blir presentert av en antigen-presenterende celle (APC). Thymus produserer derfor millioner av T-celler med millioner av forskjellige TCR.
Når en «naiv» T-celle for første gang blir presentert for et antigen, er det avgjørende for T-cellens videre skjebne om antigenet blir presentert av MHC-klasse1-molekyler eller av MHC-klasse2-molekyler. Dersom TCR og antigenet matcher, binder TRC seg til antigen/MHC-komplekset. Dersom antigenet blir presentert av MHC-klasse1-molekyler, signaliserer TRC til T-cellen at den skal differensiere seg til T-drepercelle. Dersom antigenet blir presentert av MHC-klasse2-molekyler, signaliserer TRC til T-cellen at den skal differensiere seg til T-hjelpercelle. T-celler kan ikke gjenkjenne, og kan derfor heller ikke respondere på, frie antigen.
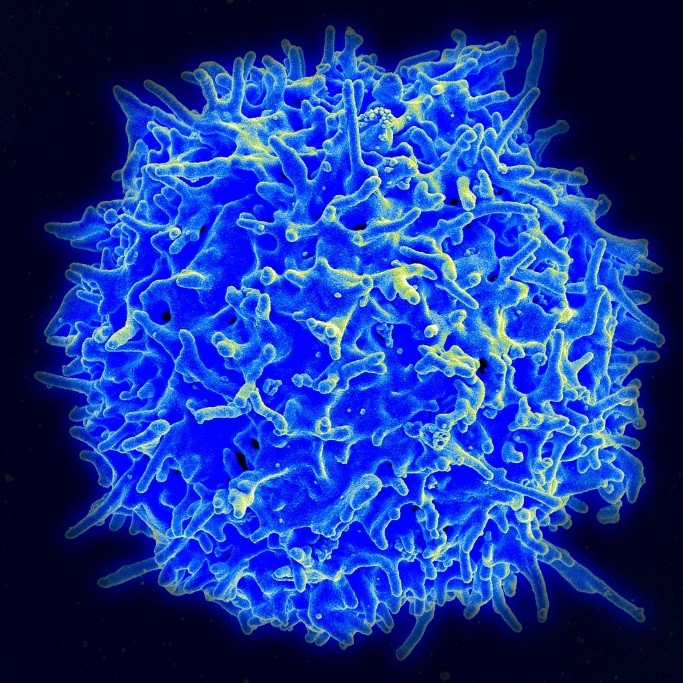
T-celle
- T-drepercelle (dvs. CD8-positiv cytotoksisk T-celle) (Wiki: Cytotoxic T cell). Når T-cellen for første gang blir presentert for et antigen av en antigen-presenterende celle (APC), og dette antigenet blir presentert av MHC-klasse1-molekyler, signaliserer TRC til T-cellen at den skal differensiere seg til T-drepercelle. T-drepercellen uttrykker da en molekylær co-reseptor, CD8, på celleoverflaten, som gjør at TRC bare kan binde seg til antigener som blir presentert av MHC-klasse1-molekyler, og disse igjen kan bare presentere intracellulære antigener. T-drepercelle benevnes gjerne som CD8-positiv T-celle.
Dersom TCR og antigenet matcher, binder TCR seg til antigen/MHC-komplekset, og T-drepercellen dreper cellen. T-drepercellen dreper kreftceller, infiserte celler (særlig av virus), og celler som på andre måter er skadet.
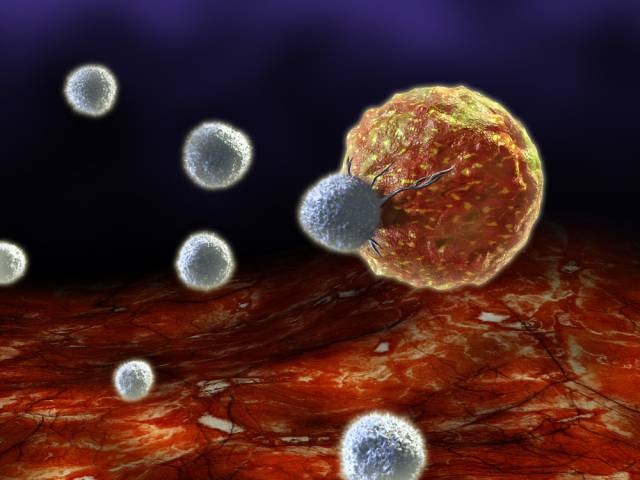
T-dreperceller strømmer til for å drepe et patogen.
- T-hjelpecelle (Wiki: T helper cell). Når T-cellen for første gang blir presentert for et antigen av en antigen-presenterende celle (APC), og dette antigenet blir presentert av MHC-klasse2-molekyler, signaliserer TRC til T-cellen at den skal differensiere seg til T-hjelpercelle. T-hjelpercellen uttrykker da en molekylær co-reseptor, CD4, på celleoverflaten, som gjør at TCR bare kan binde seg til antigener som blir presentert av MHC-klasse2-molekyler, og disse igjen kan bare presentere ekstracellulære antigener. T-hjelpercelle benevnes gjerne som CD4-positiv T-celle.
Når TCR på en T-hjelpercelle matcher det presenterte antigenet og binder seg til det, begynner T-hjelpercellen å replikere seg hurtig. Etter en rekke celledelinger begynner klonene å differensiere seg til forskjellige T-celletyper. T-hjelpercellene er svært aktive i å kommunisere med de andre aktørene i immunsystemet via cytokiner.
- T-hukommelsescelle (Wiki: Memory T cell). Når en “naiv” T-celle, dvs. en T-celle som ikke tidligere har blitt eksponert for et antigen, blir eksponert for et antigen for første gang, vil den i et fåtall av tilfellene differensiere seg til en T-hukommelse-stamcelle. Antigenet kan være et peptid fra f.eks. bakterie, virus, kreftcelle, eller vaksinasjon. Når det spesifikke antigenet dukker opp på ny, reproduserer T-hukommelsescellen seg hurtig for å aktivere en sterkere og mer effektiv immunrespons enn den som ble utløst første gang.
Ifølge en nylig artikkel av Mahnke et al. (2013), The who's who of T-cell differentiation: Human memory T-cell subsets, ser de potensielle differensieringsstadiene for en T-hukommelsescelle slik ut (de engelske termene er beholdt):
* T naive cell
* T stem cell memory cells
* T central memory cells
* T transitional memory cells
* T effector memory cells
* T terminal effector cells
- Regulatorisk T-celle (Wiki: Regulatory T cell). Dette er en undergruppe av T-celler som modulerer immunsystemet, vedlikeholder toleranse mot selv-antigener, og opphever autoimmune sykdommer. De er istand til å neddempe eller forhindre immunreaksjoner mot andre celler, og når inntrengeren er nedkjempet er de istand til å signalisere til hele immunsystemet at faren er over. Defekter i regulatoriske T-celler resulterer ofte i alvorlige autoimmune sykdommer.
B-CELLER (Wiki: B cell)
Hovedfunksjonene til B-celler er: 1) å oppdage antigener i deres opprinnelige form i blod- og lymfesystemet; 2) å utføre rollen som antigen-presenterende celle (APC); 3) å produsere frie antistoffer for å bekjempe primærinfeksjon; og 4) å produsere B-hukommelsesceller for å forberede immunresponsen dersom samme patogen skulle dukke opp på ny.
B-celler produseres kontinuerlig i beinmargen, og går der gjennom en rekke faser før de fremstår som naive, modne celler klare til å bli presentert for et antigen. Det som karakteriserer B-celler er at de har B-cellereseptorer (BCR), dvs. fastsittende antistoffer, på celleoverflaten. En typisk menneskelig B-celle har 50.000 – 100.000 BCR på sin overflate. BCR er unik for hver enkelt B-celle, og kan bare binde seg til ett spesifikt antigen. Det potensielle utviklingsforløpet til en B-celle er i hovedtrekk følgende:
1) Den naive B-cellen forlater beinmargen, uten viten/erfaring med antigen. Bare tilfeldigheter avgjør om dens BCR kan binde seg til mikrober.
2) En kritisk forskjell på B-celler og T-celler er at mens T-celler bare kan oppdage antigener som blir presentert som peptider i en prosessert form av en annen immuncelle, kan B-celler med sin BCR oppdage frie patogener i blod- eller lymfesystemet. Når BCR matcher et patogen i villform, binder BCR seg til dette. B-cellen internaliserer og prosesserer patogenet, og i rollen som en antigen-presenterende celle (APC) presenterer B-cellen et peptid fra patogenet via MHC-klasse II-molekyler. Dette tiltrekker gjerne T-hjelperceller, som binder seg til antigen/MHC-komplekset. Dette aktiverer B-cellen til å differensiere seg til enten en B-plasmacelle eller en B-hukommelsescelle.
3) B-plasmacellen produserer antistoffer som utskilles i blod- og lymfesystemet der de sirkulerer fritt. B-hukommelsesceller mangfoldiggjør seg som en forberedelse til en mer effektiv immunrepons dersom samme inntrenger skulle dukke opp på ny.
- B-plasmacelle (Wiki: Plasma cell)
B-plasmacellenes eneste oppgave er å produsere spesifikke antistoffer mot det antigenet som aktiverte B-cellen i første omgang til å differensiere seg til B-plasmacelle. Antistoffene som produseres er frie og utskilles i blod og vevsvæsker. Den enkelte B-plasmacelle kan produsere flere tusen eksemplarer av det spesifikke antistoffet pr. sekund.
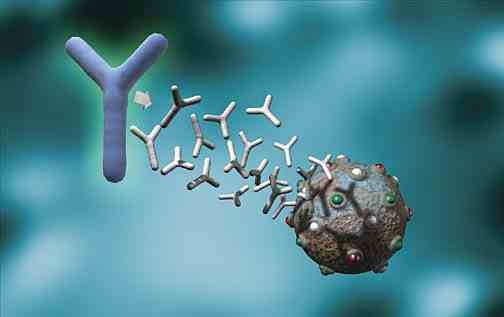
Frie antistoffer angriper en celle
- B-hukommelsescelle (Wiki: Memory B cell)
Bare et lite mindretall av B-cellene som etter aktivering differensierer seg, ender opp som spesifikke B-hukommelsesceller. Disse hukommelsescellene er under primærinfeksjonen passive, og kan ha et langt liv i «dvale» foran seg. Men dersom det spesifikke antigenet skulle dukke opp på ny, kanskje flere år senere, øker produksjonen av disse hukommelsescellene. Det er denne tiltagende forsterkningen av det adaptive immunforsvaret mot tidligere oppdagete antigener som er kjent som den sekundære immunresponsen, og som er grunnlaget for vaksinasjon.
Antistoff (Wiki: Antibody)
Et antistoff er et stort Y-formet protein produsert av B-plasmaceller som brukes av immunsystemet til å gjenkjenne og nøytralisere fremmede objekter som f.eks. bakterier og virus. Hver av de to «armene» på Y-en ender i det som kan minne om «kjeften» på en fastnøkkel, og kjeften er nøye designet til å omfavne og binde fast en unik del på fremmedobjektet. Det er fem hovedvarianter av antistoffer, kalt IgA, IgD, IgE, IgG og IgM. De skiller seg fra hverandre når det gjelder biologiske egenskaper, i hvilke vev de fungerer, og deres evne til å mestre forskjellige typer antigener.
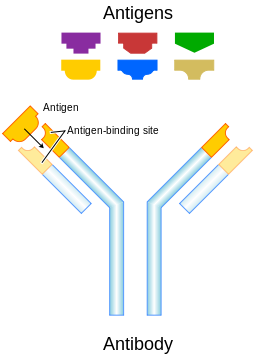
B-cellereseptor (BCR) og antistoff.
Ved å binde seg til antigenet kan antistoffet enten tagge en mikrobe eller en infisert celle slik at denne blir angrepet av andre deler av immunforsvaret, eller antistoffet kan selv nøytralisere målobjektet direkte, f.eks. ved å blokkere en del av mikroben som er essensiell for dens invasjon eller overlevelse.
Det var den tysk-jødiske lege og forsker Paul Ehrlich som i en artikkel fra 1891 første gang brukte ordet antistoff. Termen var ment som en generalisering av ordet antitoksin, som hadde blitt lansert av Emil von Behring og Shibasaburo Kitasato for noen substanser i kroppen som nøytraliserte giftstoffene som ble produsert av difteribakterien og tetanusbakterien. I 1948 oppdaget den svenske forskeren Astrid Fagreaus at det var B-celler, i form av B-plasmaceller, som er ansvarlig for å produsere antistoffer.